مروری کوتاه
فناوری ویرایش ژن CRISPR میتواند پزشکی را متحول کند، اما رساندن مؤثر آن به بافتها و سلولهای مرتبط با بیماری چالشی جدی است.
اکنون یک سیستم انتقال جدید که CRISPR را درون نانوذرات «اسید نوکلئیک کروی» (SNA) بارگذاری میکند، این مشکل را به شکل چشمگیری حل کرده است.
این ذرات توانستند سه برابر بهتر وارد سلول شوند، سه برابر کارایی ویرایش ژن را افزایش دهند و در مقایسه با روشهای رایج، سمیت بسیار کمتری ایجاد کنند.
گامی بزرگ در بهبود انتقال CRISPR
فناوری CRISPR قابلیت بازنویسی کد ژنتیکی که اساس بسیاری از بیماریهاست را دارد. با این حال، تا زمانی که ابزارهای ویرایش ژنی با ایمنی و کارایی بالا به سلولهای هدف منتقل نشوند، این قابلیت عملی نخواهد شد.
شیمیدانان دانشگاه نورثوِسترن نوع جدیدی از نانوساختار را معرفی کردهاند که انتقال CRISPR را بهشدت بهبود میدهد و دامنه کاربردهای آن را گسترش میدهد.
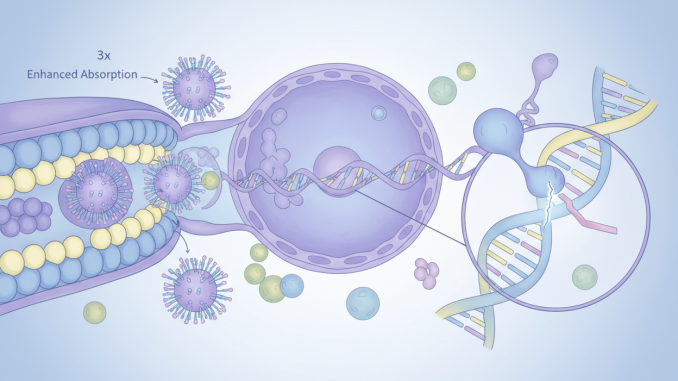
این ساختارهای جدید که نانوذرات لیپیدی حامل اسید نوکلئیک کروی (LNP-SNA) نام دارند، شامل تمام اجزای CRISPR — آنزیم Cas9، RNA راهنما و الگوی ترمیم DNA — هستند که در پوششی متراکم از DNA محافظت میشوند. این لایه DNA نه تنها از محموله محافظت میکند، بلکه تعیین میکند ذرات به کدام بافتها سفر کنند و چگونه وارد سلول شوند.
در آزمایشهای سلولهای انسانی و حیوانی، LNP-SNAها تا سه برابر بهتر وارد سلول شدند، سمیت بسیار کمتری داشتند و کارایی ویرایش ژن را سه برابر افزایش دادند. همچنین موفقیت ترمیم دقیق DNA را بیش از ۶۰ درصد نسبت به روشهای فعلی افزایش دادند.
این مطالعه در ۵ سپتامبر 2025 در مجله PNAS منتشر شد.
اهمیت معماری نانومواد در پزشکی نوین
این مطالعه مسیر تولید داروهای ژنتیکی ایمنتر و قابلاعتمادتر را هموار میکند و نشان میدهد که معماری نانومواد — و نه صرفاً ترکیبات آنها — تعیینکننده قدرت درمانی آنهاست.
این اصل، پایه «نانوداروی ساختاری» است؛ حوزهای نوظهور که توسط چاد ای. میرکین و همکارانش بنیانگذاری شده است.
به گفته میرکین:
«CRISPR ابزاری بسیار قدرتمند است، اما رساندن آن به سلولها و بافتهای مناسب به یک معجزه کوچک نیاز دارد. با بهرهگیری از SNAها، تلاش کردیم کارایی CRISPR را به حداکثر برسانیم و تعداد سلولهایی را که میتوان به آنها دارو رساند افزایش دهیم.»
چرا CRISPR به یک «وسیله حمل» نیاز دارد؟
CRISPR پس از ورود به سلول میتواند ژنها را غیرفعال کند، جهشها را اصلاح کند و عملکردهای جدید اضافه کند. اما نمیتواند بهتنهایی وارد سلول شود و نیاز به یک «وسیله انتقال» دارد.
امروزه برای انتقال CRISPR از دو روش استفاده میشود:
۱. ناقلهای ویروسی
- کارایی بالا
- اما میتوانند پاسخ ایمنی شدید ایجاد کنند
۲. نانوذرات لیپیدی (LNP)
- ایمنتر
- اما کارایی پایین دارند؛ زیرا در اندوزومها گیر میکنند و نمیتوانند محموله را آزاد کنند.
میرکین توضیح میدهد:
«تنها بخش کوچکی از CRISPR وارد سلول میشود و مقدار باز هم کمتری به هسته میرسد.»
SNAها: تاکسیهای DNA برای CRISPR
برای غلبه بر این مشکل، تیم میرکین از اسید نوکلئیک کروی استفاده کرد؛ ساختاری کروی از DNA یا RNA که دور یک هسته نانوذرهای قرار میگیرد.
این ساختارها (حدود ۵۰ نانومتر قطر) قبلاً نشان دادهاند که سلولها بهطور فعال آنها را جذب میکنند. تاکنون هفت درمان مبتنی بر SNA وارد کارآزماییهای بالینی شدهاند.
در این مطالعه:
- هسته LNP با نیروی CRISPR پر شد
- سطح آن با لایهای متراکم از DNA پوشیده شد
- DNA میتواند سلولهای هدف را انتخاب و ورود به سلول را تسهیل کند
میرکین میگوید:
«تغییرات کوچک در ساختار ذره میتواند میزان جذب آن توسط سلول را بهطور چشمگیری افزایش دهد.»
افزایش عملکرد در تمام زمینهها
پس از سنتز موفق LNP-SNAهای حامل CRISPR، این ذرات در محیط کشت سلولهای گوناگون — از جمله سلولهای پوستی، گلبولهای سفید، سلولهای بنیادی مغز استخوان و سلولهای کلیه — آزمایش شدند.
تیم تحقیقاتی موارد زیر را اندازهگیری کرد:
- میزان ورود ذرات به سلول
- میزان سمیت
- موفقیت انتقال ژن
- میزان ویرایش ژن توسط CRISPR
در تمام موارد، سیستم جدید عملکرد بسیار بهتری داشت و توانست ویرایشهای پیچیده ژنتیکی را امکانپذیر سازد.
گام بعدی، آزمودن این سیستم در مدلهای بیماری زنده است. این پلتفرم ماژولار است و میتوان آن را برای اهداف درمانی متعدد تنظیم کرد.
شرکت Flashpoint Therapeutics در حال تجاریسازی این فناوری است.
میرکین میگوید:
«CRISPR میتواند کل پزشکی را تغییر دهد، اما طراحی وسیله انتقال بهاندازه ابزارهای ژنتیکی اهمیت دارد.»
«با ترکیب CRISPR و SNAها، راهبردی ایجاد کردهایم که میتواند پتانسیل درمانی کامل CRISPR را آزاد کند.»
تهیه و تنظیم: سید طه نوربخش
نظارت و تأیید: فائزه محمدهاشم-متخصص ژنتیک