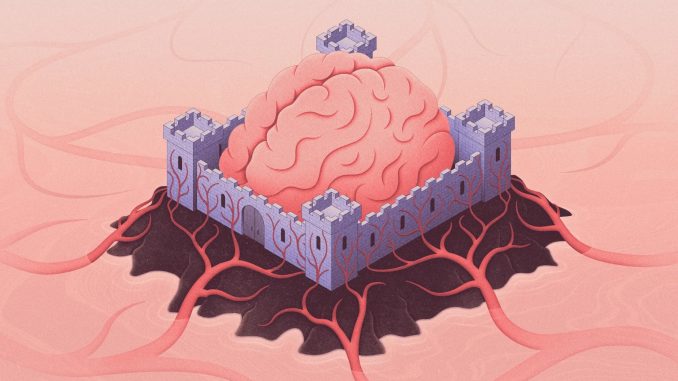
عبور داروهای درمانی از سد خونی-مغزی (Blood-Brain Barrier) همواره یکی از بزرگترین چالشهای پزشکی بوده است؛ چالشی که توانایی ما برای درمان بیماریهایی چون آلزایمر، پارکینسون و سرطانهای مغزی را بهشدت محدود کرده است.
اگرچه دستکاری بیان ژن در سلولهای مغزی امیدهای بزرگی برای درمان این بیماریها به وجود آورده، اما رساندن مؤثر داروهای ژنمحور به مغز همچنان هدفی دستنیافتنی باقی مانده است.
در این زمینه، تیمی پژوهشی از دانشگاه علوم توکیو (TUS) به رهبری پروفسور ماکیا نیشیکاوا در حال بررسی راهکارهایی برای بهبود رسانش الیگونوکلئوتیدهای آنتیسنس (ASOs) — دستهای نویدبخش از داروهای ژنمحور — به مغز و سایر اندامها هستند. این پژوهش در راستای تحقق اهداف توسعه پایدار سازمان ملل (SDGs)، به ویژه ارتقای سلامت و رفاه عمومی (هدف سوم) و تقویت صنعت، نوآوری و زیرساخت (هدف نهم)، صورت گرفته است.
در تازهترین مطالعهی آنها که در ۱۸ فوریه ۲۰۲۵ بهصورت آنلاین در Journal of Controlled Release منتشر شد، پژوهشگران به بررسی مکانیزمهایی پرداختند که تعیین میکند این ترکیبات چه مدت در خون باقی میمانند، به چه موادی متصل میشوند و به کدام بافتها دسترسی پیدا میکنند. این مطالعه با همکاری یوکیتاکه یوشیوکا از TUS و شونسوکه یاماموتو، مدیر ارشد شرکت داروسازی تاکدا، انجام شده است.
با توجه به توانایی ASOها در تنظیم بیان ژن در سلولها، این ترکیبات به موضوعی داغ در تحقیقات پزشکی تبدیل شدهاند. ASOها از یک رشتهی منفرد DNA تشکیل شدهاند که توالی بازهای آن مکمل یک RNA پیامرسان (mRNA) هدف است. با اتصال به mRNA هدف، این ترکیبات میتوانند مانع تولید پروتئینهای خاصی در سلولها شوند.
با وجود این پتانسیل بزرگ، ASOها به خوبی به مغز نمیرسند و به سرعت از خون پاکسازی میشوند؛ مشکلی که اثربخشی آنها را محدود میکند.
برای حل این مشکل، پژوهشگران به نوع جدیدی از ترکیبات ژنمحور به نام الیگونوکلئوتیدهای هتروپلکس (HDOs) روی آوردند. عملکرد HDOها مشابه ASOهاست، اما با افزودن یک رشتهی RNA مکمل، پایداری و اختصاصیت آنها افزایش مییابد. نکتهی جالبتر این است که این رشتهی RNA میتواند با اتصال یک مولکول کلسترول (Chol) به آن اصلاح شود و ترکیبی به نام Chol-HDO ایجاد کند.
با توجه به گزارشهای اخیر مبنی بر توانایی بالای Chol-HDO در رسیدن به اندامهای مختلف — از جمله مغز — تیم پروفسور نیشیکاوا تصمیم گرفت فارماکوکینتیک این ترکیبات را در مقایسه با ASOها و HDOها بررسی کند و چگونگی توزیع آنها در بدن را روشن سازد.
برای این منظور، پژوهشگران مجموعهای از آزمایشها را روی موشها و موشهای صحرایی انجام دادند و از تکنیکهایی چون کروماتوگرافی مایع همراه با طیفسنجی جرمی دوبل (LC-MS/MS)، میکروسکوپ فلورسانس با نور صفحهای (light-sheet microscopy) و الکتروفورز ژل پلیآکریلآمید (PAGE) استفاده کردند.
نتایج این تحلیلهای دقیق نشان داد که برخلاف HDOها و ASOها، Chol-HDOها قادرند از رگهای خونی عبور کرده و وارد قشر مغز شوند؛ که گامی اساسی برای درمان بالقوهی بیماریهای مغزی محسوب میشود.
راز این موفقیت در نحوهی تعامل Chol-HDOها با پروتئینهای موجود در خون نهفته است.
پروفسور نیشیکاوا توضیح میدهد: “ما دریافتیم که HDOها از طریق برهمکنشهای الکترواستاتیکی با پروتئینهای سرم پیوند ضعیفی برقرار میکنند و به راحتی توسط سلولها جذب میشوند. اما در مقابل، Chol-HDOها از طریق برهمکنشهای آبگریز بهطور محکم به پروتئینهای سرم، از جمله لیپوپروتئینها، متصل میشوند.”
این اتصال قوی باعث میشود Chol-HDOها آهستهتر از جریان خون پاکسازی شوند، که به آنها زمان بیشتری برای رسیدن به مغز میدهد.
جالب اینجاست که پژوهشگران نشان دادند مهار گیرندههای اسکاونجر در سلولها باعث کاهش جذب هر دو ترکیب ASO و Chol-HDO در کبد و کلیهها میشود، که درک جدیدی دربارهی نحوهی جذب این ترکیبات در اندامهای مختلف ارائه میدهد.
مجموع این یافتهها مسیر طراحی داروهای مغز-محور مبتنی بر Chol-HDOها را روشنتر میکند.
پروفسور نیشیکاوا در این باره میگوید:”امکان رساندن مؤثر ASOها و سایر داروهای مبتنی بر اسید نوکلئیک به مغز، میتواند به توسعهی درمانهایی برای بیماریهای مغزی با نیازهای درمانی برآوردهنشدهی قابلتوجه منجر شود.”
امروزه بیش از ۵۵ میلیون نفر در جهان با زوال عقل (دمانس) زندگی میکنند؛ بیماریهایی که اگر امکان رساندن ترکیبات دارویی مناسب به آن سوی سد خونی-مغزی وجود داشت، قابل درمان یا پیشگیری بودند.
در مورد سرطانهای مغزی نیز، سالانه حدود ۳۰۰ هزار مورد در سراسر جهان گزارش میشود. با تداوم تحقیقات، HDOهای اصلاحشده میتوانند راه را برای نسل جدیدی از داروهای مؤثر بر بیماریهای مغزی هموار کنند و امید تازهای برای میلیونها بیمار و خانوادههای آنان در سراسر جهان به ارمغان آورند.
منبع:
Pharmacokinetics and protein binding of cholesterol-conjugated heteroduplex oligonucleotide. Journal of Controlled Release, 2025; 380: 787 DOI: 10.1016/j.jconrel.2025.02.025
تهیه و تنظیم: سید طه نوربخش
نظارت و تأیید: فائزه محمدهاشم-متخصص ژنتیک